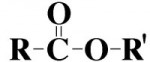O carbono é o elemento básico da química orgânica, pertencendo a família 14, antiga IV A da tabela periódica. Apresenta 4 elétrons de valência na última camada eletrônica, podendo fazer ligações entre si e com outros elementos, para tornar-se estável, fazendo ligações covalentes de par em par. A união de átomos de carbono com átomos de hidrogênio formam os compostos hidrocarbonados.
Os compostos orgânicos se diferenciam dos inorgânicos por apresentarem átomos de carbono distribuídos em cadeias e/ou átomos de carbono ligados diretamente a hidrogênio. Assim, o metano (CH4) é um composto orgânico, mas o ácido carbônico (H2CO3) não.
CADEIAS CARBÔNICAS:
São formadas por hidrocarbonetos, e podem ser classificadas da seguinte forma:
A) Cadeias abertas, acíclicas ou alifáticas: tipo de cadeia carbônica onde os carbonos da extremidade não se encontram. Esses carbonos são conhecidos como carbonos primários, sendo os demais classificados pelo número de ligações que fazem com outros átomos de carbono, veja o esquema abaixo:
B) cadeias fechadas ou cíclicas: é o tipo de cadeia carbônica onde os carbonos primários da extremidade irão se encontrar:
C) Cadeia homogênea: tipo de cadeia carbônica que só apresenta átomos de carbono na cadeia principal:
D) Cadeia heterogênea: tipo de cadeia carbônica que apresenta um ou mais átomos que não sejam o carbono na cadeia principal:
TIPOS DE LIGAÇÃO:
1) CADEIA SATURADA: hidrocarbonetos onde os carbonos se ligam somente a átomos de hidrogênio:
2) CADEIA INSATURADA: onde aparecem ligações duplas ou triplas entre átomos de carbono nas cadeias de hidrocarbonetos:
FORMULAÇÕES:
A) FÓMULA ESTRUTURAL:
B) FÓRMULA ESTRUTURAL CONDENSADA:
C) FÓRMULA MOLECULAR:
Os compostos orgânicos podem ser classificados conforme os átomos constituintes, radicais ligantes ou natureza das ligações. Portanto essas características agrupam os compostos por semelhança que formam, assim, as funções orgânicas:
Hidrocarbonetos
São compostos constituídos por, apenas, átomos de carbono e hidrogênio. Sendo essa função composta por uma ampla gama de combustíveis (metano, propano, acetileno).
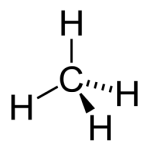
Hidrocarboneto - Metano
A) ALCANOS OU PARAFINAS:
Os alcanos, também chamados parafinas, são hidrocarbonetos alifáticos saturados, de fórmula geral CnH2n+2. Estes se apresentam em cadeias lineares ou ramificadas. Os alcanos lineares são designados, na nomenclatura oficial, através de prefixos, geralmente gregos, seguidos do infixo "an" e sufixo "o".
B) ALCENOS OU ALQUENOS:
Alcenos são os hidrocarbonetos alifáticos insaturados, isto é, que apresentam uma ligação covalente dupla (C═C) entre seus átomos de carbono.
Fórmula geral:
CnH2n
C) ALCINOS, ALQUINOS OU ACETILENOS:
Alcinos são os hidrocarbonetos alifáticos insaturados, isto é, que apresentam uma ligação covalente tripla entre átomos de carbono sem que a seqüência de carbonos forme um ciclo.
Fórmula geral:
CnH2n-2
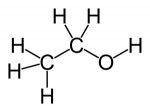
Alcoóis
Os alcoóis são constituídos por radicais de hidrocarbonetos ligados a uma ou mais hidroxilas. Entretanto, nunca podem ser considerados bases de Arrhenius (pois não liberam essa hidroxila em meio aquoso).
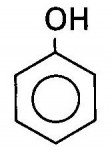
Fenóis
São cadeias aromáticas (hidrocarbonetos) ligados a uma ou mais hidroxilas. Diferindo-se dos alcoóis, portanto, por apresentarem estrutura em anéis rodeados por grupos OH.
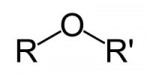
Éteres
São compostos por um átomo de oxigênio entre duas cadeias carbônicas. Sendo estas cadeias também de hidrocarbonetos (radicais alquila ou arila).
Ésteres
São semelhantes aos éteres por possuírem átomos de oxigênio entre as cadeias carbônicas (radicais). Porém, diferem-se destes por possuírem um grupo carbonilo (CO) também entre os carbonos. Assim, a molécula é estruturada por: radical – carbonilo – oxigênio – radical.
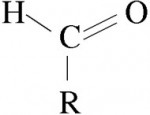
Aldeídos
São formados por um radical orgânico (alifático ou aromático) ligado a um ou mais grupos formilo (HCO).
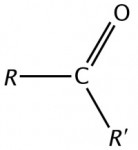
Cetonas
São compostas por dois radicais orgânicos (alifáticos ou aromáticos) ligados entre si pelo grupo carbonilo (CO). É a essa função que pertence a acetona comercial (propanona - CH3COCH3).
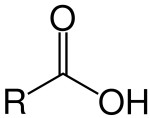
Ácidos carboxílicos
São radicais alquila, alquenila, arila ou hidrogênio ligados a pelo menos um grupo carboxílico (COOH). E, geralmente, são ácidos fracos (liberam poucos íons H+ em meio aquoso).
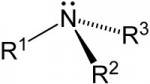
Aminas
São compostos nitrogenados onde até três radicais orgânicos (arila ou alquila) se ligam a um átomo de nitrogênio pela substituição de átomos de hidrogênio da molécula de amônia. De modo que um radical liga-se ao -NH2, dois radicais a -NH e três radicais a -N.
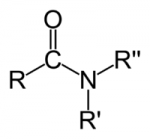
Amidas
São bem parecidas com as aminas, exceto pela presença do grupo carbonilo. Assim, até três radicais acila (RCO) se ligam a um átomo de nitrogênio pela substituição de átomos de hidrogênio do amoníaco. Ou seja, as amidas possíveis são: RCONH2, (RCO)2NH, e (RCO)3N.
Haletos orgânicos
São compostos formados por halogênios (com NOx -1) que substituem átomos de hidrogênio pela reação de halogenação. É nessa função orgânica que se encontram os CFC (clorofluorcarbonetos).
Nomenclatura Hidrocarbonetos: PREFIXO+INTERFIXO+SUFIXO
PREFIXO, se baseia no número de carbonos na cadeia principal:
Qundo a cadeia for fechada, começar com CICLO.
1 carbono = MET
2 carbonos = ET
3 carbonos = PROP
4 carbonos = BUT
5 carbonos = PENT
6 carbonos = HEX
7 carbonos = HEPT
8 carbonos = OCT
9 carbonos = NON
10 carbonos = DEC
INTERFIXO
LIGAÇÃO SATURADA = AN
LIGAÇÃO INSATURADA DUPLA = EN
LIGAÇÃO INSATURADA TRIPLA = IN
SUFIXO,vai depender do tipo de função orgânica presente na cadeia, no caso do alcanos, alcenos e alcinos, o sufixo terminará em "o".
RADICAIS ORGÂNICOS: Os radicais orgânicos aparecem presos à cadeia principal, com terminação em IL, para ser um radical.
Nomenclatura dos Aldeídos
PREFIXO = Nº DE CARBONOS
INTERFIXO = SATURADO(AN), INSATURADO DUPLO(EN), INSATURADO TRIPLO(IN)
SUFIXO = AL
Nomenclatura dos álcoois
PREFIXO = Nº DE CARBONOS
INTERFIXO = SATURADO(AN), INSATURADO DUPLO(EN), INSATURADO TRIPLO(IN)
SUFIXO = OL
Nomenclatura dos Fenóis
Para formar o nome de um fenol basta seguir a regra:
- Começar com hidroxi (OH) seguido do restante da molécula, considerada como hidrocarboneto.
Exemplo:
Hidroxibenzeno (oficial - OH ligado à um radical Fenil) C6H5OH
Fenol comum - usual
Ácido fênico - usual
Quando existem mais radicais ligados ao anel aromático, eles serão prefixados de Orto (o), Meta (m) e Para (p), respectivamente, em relação à Hidroxila. Exemplo:

o-hidroximetil benzeno (oficial)
o-cresol (usual)
o-hidroxitolueno (usual)

m-hidroximetilbenzeno (oficial)
m-cresol (usual)
m-hidroxitolueno (usual)

o-diidroxibenzeno (oficial)
Catecol (usual)
Nomenclatura das cetonas
É igual ao dos hidrocarbonetos, tendo com sufixo a terminação ONA.
Nomenclatura dos Éteres
- Número de carbonos do menor radical ligado ao oxigênio + OXI + nome do maior radical, porém como se fosse umhidrocarboneto.
Exemplos: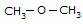
Metoximetano (iupac)
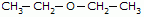
Etoxietano (iupac)
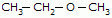
Metoxietano (iupac)
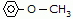
Metoxibenzeno (iupac)
Nomenclatura Éster Oficial
Para o radical R sem ramificações, deve-se nomeá-la de acordo com o número de átomos de carbono; determina-se a saturação das ligações, para em seguida, completar com o radical R’.
Caso o radical R seja ramificado, deve-se nomear os radicais de acordo com a posição na cadeia (numerando-se os átomos de carbono); nomear a cadeia R quanto ao número de átomos de carbono; determinar a saturação das ligações e complementar com o radical R’.
Para ambos os casos, deve-se completar a nomenclatura de todo o radical R com o sufixo ATO. Exemplos:
Nomenclatura oficial dos Ácidos carboxilícos:
A nomenclatura oficial é bem parecida com a dos hidrocarbonetos
Nomenclatura oficial das Aminas:
A nomenclatura das aminas é feita utilizando o sufixo "amina" depois dos nomes dos radicais ligados ao grupo funcional:
Etilamina (CH3-CH2-NH2)
Também pode ser utilizado o nome do hidrocarboneto, ao invés do radical:
Etanoamina (CH3-CH2-NH2)
Metanoetanoamina, Metiletilamina (CH3-NH-CH2-CH3)